|
|
爱科技、爱创意、爱折腾、爱极致,我们都是技术控
您需要 登录 才可以下载或查看,没有账号?立即注册
x
据有关统计:传统药物研发耗时耗力,一般需要超过 15 年,耗资 30 多亿美元,但每年上市的原创新药仅十几种。目前,已知的 4000 多种疾病中 90% 尚无药可治。
如何加速新药研发?腾讯表示,为解决困难,开始做些尝试——发布首个 AI 驱动的药物发现平台 “云深智药(iDrug)”。它致力于帮助用户大幅度减少寻找潜在活性药物的时间和成本。“云深”源自唐诗《寻隐者不遇》的 “只在此山中,云深不知处”,新药的发现过程正是如此。
基于腾讯 AI Lab 自主研发的深度学习算法,提供数据库和云计算支持,能覆盖临床前新药研发全部流程的五大模块。

腾讯表示,其 AI Lab 自研的预测蛋白质结构的新思路,该算法在 2020 年起加入行业顶级评估平台 CAMEO(全球唯一的蛋白质结构预测自动评估平台)。
目前平台上已经运行十个左右研发项目——包括对抗新冠病毒药物的虚拟筛选和性质预测,目前筛选得到的化合物在实验验证中。
平台如何为药物研发加速助力?
疾病的形成由很多物质组成,最终形成疾病的关键蛋白,我们把它设为靶点。
解决靶点,就有可能解决疾病。
而解决靶点,就需要知道它的蛋白结构,再去找到对应的药物破解它。
了解关键蛋白的结构,设计药物分子来抑制它的功能,疾病就会解除。
过去通过实验寻找针对疾病靶点的有效药物,往往难度大、周期长、费用高。
从进入临床试验的行业案例来看,在新药研发中,AI 技术最快可以将新药发现周期从 3-6 年缩短到 6 个月至 1 年;从技术层面看,云深智药平台同样具备相似的能力。它能最快的时间,模拟锁的结构。
结合 AI 深度学习模型预测的蛋白质结构以及蛋白质功能(蛋白质折叠),就可以有针对性地设计药物分子来抑制它的功能,将疾病通路阻断。
基于自监督学习的蛋白质折叠方法,不依赖同源序列,而是直接从序列数据库中通过自监督学习,学得共进化的模式,从而能够从无到有地产生出含有共进化信息的伪同源序列,并最终让这些蛋白能够有效折叠。
通过一种基于深度学习的可迭代方法,有效整合模板建模与自由建模,首次提出了动态的、可迭代的氨基酸对特异性的约束条件,显著提高了建模的精度,从而更好的折叠蛋白。
云深智药平台,不仅可以根据锁的类型和形状来设计或者选择合适的候选钥匙,还能吸收其他人开锁经验,能极大节省人力物力。
可通过 AI“迁移 ”从其他靶点上面学习到的知识(如分子局部结构对靶点结合强度的影响),应用在目标靶点上来提高模型预测精度。
目前该算法在数千个实验数据集上预测精度(预测活性与实验测量活性的相关性)的中位数从目前最高记录 0.36 提升到 0.42,且筛选可用模型的百分比从 56% 提升到 60%。
IT之家获悉,平台还支持 ADMET 性质预测功能(药物的吸收、分配、代谢、排泄和毒性),目前已经开源。该平台药物小分子 ADMET 属性预测模块已在多个数据集上比学术界现有最好模型提高 3%~11%;在合作伙伴的反馈中,平台的自研算法精度超过现有商业软件 6%~37% 不等。
当然,除了上述在算法领域不断创新,平台还提供算力和数据库的一体化服务支撑。
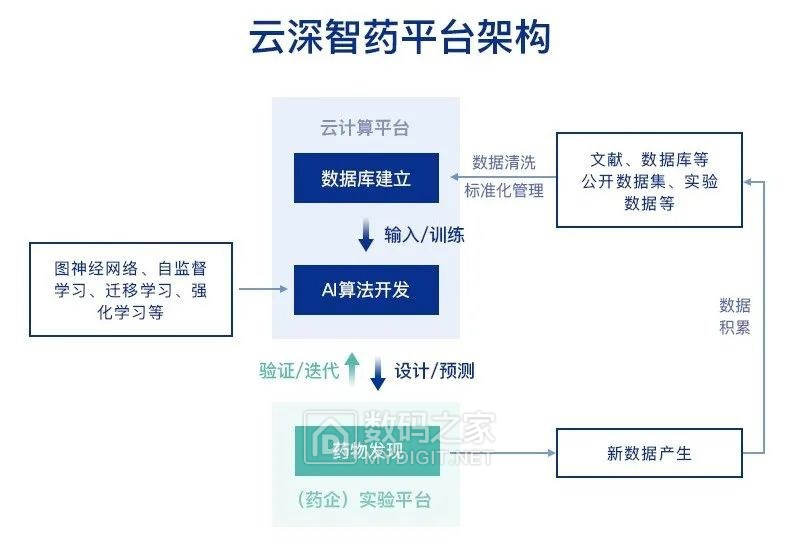
数据方面,分子大数据是药物研发中的基础设施。
云深智药平台使用的分子大数据,基于现有公开数据集,进行了多个环节的精细清洗整理工作,得到可以用于直接构建深度学习模型的药物分子大数据集。
算力方面,腾讯云为云深智药平台提供数据库服务。
药企、科研机构登录平台即可开展研究,不需要再自行部署计算资源,从而能尽快将 AI 能力引入现有的研发流程中。
本文出处:IT之家
|
|